Introduction
Le but de cet article est de fournir aux utilisateurs de DMI-65 milieu de filtration catalytique de l’eau des informations qualitatives sur le fonctionnement du matériau, ses capacités et ses limitations et de leur permettre d’appliquer le matériel aux processus de traitement de l’eau de la manière appropriée et avec confiance. L’article évite la complexité détaillée des couches électrochimiques de surface solide et de la science colloïdale, des processus physiques et chimiques quantitatifs et des réactions. Pour les lecteurs ayant déjà des connaissances significatives dans ce domaine, le document apporte une meilleure compréhension de ce que DMI-65 est et son utilisation prévue. Les nouveaux arrivants dans ce domaine sont dotés des bases, et peut-être de la motivation, pour diriger leurs études plus approfondies comme ils pourraient le souhaiter.
Histoire
Dans les premiers jours du traitement de l’eau, des zéolites naturels (comme les greensand glauconites) étaient utilisés pour ramollir et enlever le fer et le manganèse du maquillage de la chaudière et de traiter les eaux. À mesure que la demande d’eau de meilleure qualité augmentait (en partie en raison de chaudières de classe à pression plus élevée), l’industrie du traitement de l’eau s’est largement éloignée de ces produits pour s’adoucir vers les résines d’échange d’ions synthétiques nouvellement développées.
Cependant, dans le cas de l’enlèvement de fer et de manganèse, ce mouvement était beaucoup plus lent et le résultat a été que l’utilisation des milieux de filtration glauconite greensand (greensand) se poursuit jusqu’à présent. Greensand a été et est souvent utilisé comme une étape de prétraitement avant les processus d’échange d’ions puisque le fer dans une eau d’alimentation peut et ne faute de la résine de cation. D’autres processus incluent l’aération et l’oxydation-filtration avec des filtres de support standard ou des types exclusifs de médias et/ou de filtres
Bien qu’il y ait eu d’autres produits et procédés d’enlèvement de fer/manganèse développés depuis que greensand a été introduit l’utilisation des greensand a continué même si il y avait plusieurs issues qui en ont fait un média moins qu’idéal. Il a fallu une régénération périodique avec du permanganate de potassium, ne pouvait pas être utilisé dans les eaux inférieures de pH ( < 6.2), a eu une température de fonctionnement relativement basse (80oF), et a eu tendance à ramollir au fil du temps ayant pour résultat des issues de chute de pression à des taux d’écoulement plus élevés. En outre, l’approvisionnement pourrait parfois être limité en raison de préoccupations environnementales avec les installations de traitement le long de la côte est des États-Unis.
En raison de ces problèmes dans les années 1970, les entreprises de traitement de l’eau et les utilisateurs finaux ont commencé à exprimer un intérêt pour «autre chose» pour remplacer les greensand. En réponse à leurs demandes, les scientifiques et les chercheurs au Japon ont commencé à chercher des moyens d’infuser des agents oxydants à différents matériaux de matrice. On a estimé qu’un produit produit commercialement pourrait être rendu plus puissant, avoir de meilleures propriétés physiques et être plus sujet à des améliorations et/ou à des modifications que n’importe quel média naturel.
Des décennies de recherche et de développement ultérieurs de la technologie japonaise d’infusion ont abouti au produit unique australien, DMI-65 un milieu catalytique granulaire utilisé pour stimuler la réduction avancée / oxydation (redox) processus dans l’eau. Le média fait partie d’une large catégorie de produits qui retirent leur action physique et chimique de l’interaction de leur surface d’oxyde métallique avec les molécules d’eau et les ions en solution. Ce produit est révolutionnaire grâce à la technologie d’infusion exclusive qui pénètre le substrat micro verse du matériau matrice, permettant une plus grande surface catalytique et d’une distribution serrée de la taille des particules. DMI-65 a un faible niveau d’amendes, une tolérance à une gamme de pH plus large et une surface catalytique chimiquement infusée qui ne sera pas consommée ou diminuée dans des conditions d’exploitation normales. Dernières 5 à 10 ans d’utilisation continue.
Informations de base
DMI-65 est un milieu de filtration d’eau catalytique extrêmement puissant qui est conçu pour l’enlèvement du fer et du manganèse dans des solutions aqueuses (eau) sans avoir besoin de permanganate de potassium ou de régénération chimique. La structure microporous unique de DMI-65 élimine efficacement le fer dissoudre aux niveaux presque indétectables aussi bas que 0,001 ppm et le manganèse à 0,001 ppm. DMI-65 agit comme catalyseur d’oxydation avec oxydation immédiate et filtration des précipités insolubles dérivés de cette réaction d’oxydation. DMI-65 peut également éliminer l’arsenic, l’aluminium et d’autres métaux lourds et le sulfure d’hydrogène dans certaines conditions.
Le matériau fait partie de la large catégorie de produits qui puisent leur action physique et chimique de l’interaction de leur surface d’oxyde métallique avec les molécules d’eau et les ions en solution.
L’interaction de surface solide avec l’eau distingue entre l’adsorption que les forces faibles van der Waal qui détiennent une molécule hydrophobe dans un support de noyau rigide tel que le carbone activé et l’absorption que les forces van der Waal faibles qui détiennent une molécule hydrophobe dans une matrice gonflée (comme le benzène) dans un polymère de styrène de T-butyl ou absorption par extraction liquide. Les résines d’échange d’ions utilisent des processus d’absorption tandis que l’interaction de DMI-65 avec des molécules d’eau et des ions en solution est initiée par adsorption.
Les matériaux adsorbents de type non catalytique conservent les ions cibles de l’eau jusqu’à ce que les sites disponibles pour l’adsorption atteignent une densité maximale et la saturation ou la concentration des ions cibles dans l’eau traitée atteignent une concentration maximale acceptable. À ce stade, le matériau adsorbent doit être régénéré pour enlever ou remplacer les ions contaminants, ou le matériau utilisé est remplacé par du nouveau matériau qui est chargé dans le conteneur de traitement. Lorsque le processus fonctionne en échangeant un type d’ion contre des ions cibles de l’eau, le processus est appelé échange d’ions. Cette catégorie d’adsorbent et certains matériaux partiellement absorbants éliminent les ions cibles de l’eau. Plus la surface par volume de matériaux est grande, plus la quantité d’ions cibles contaminants pouvant être conservées dans l’eau est grande.
Les matériaux purement catalytiques adsorb les ions réactifs de la solution les apportant à proximité de la liaison chimique. Ensuite, le produit de réaction s’éloigne de la surface du catalyseur. Les catalyseurs à proprement parler facilitent les réactions chimiques; ils n’enlèvent implicitement rien. Si le produit de réaction est un précipité solide, souvent le produit est conservé dans le lit catalytique, donc enlevé par filtration.
De nombreux matériaux agissent en mode mixte; avec l’échange d’ions et l’action catalytique ayant lieu. Pour les matériaux utilisés principalement pour leur action catalytique, l’échange d’ions entraînant la dissolution de la couche catalytique conduit à la nécessité d’une régénération ou d’une réactivation périodique pour corriger la matrice des ions à leur surface active.
DMI-65 – Médias catalytiques avancés d’oxydation
DMI-65 est un matériau granulaire de couleur brun foncé à noir. Cette couleur est produite par l’oxyde de manganèse dans les couches extérieures des granules. DMI-65 est un média catalytique dans le vrai sens du mot et facilite l’oxydation – précipitations – filtration et ne se consume pas dans les réactions. Strictement parlant, les médias facilitent les réactions chimiques et ne suppriment rien explicitement. Une fois oxydé, l’aspect de filtration de profondeur des milieux élimine les solides qui sont ensuite périodiquement resslavés des vaisseaux filtrants.
Le média n’a pas besoin de régénération ou de réactivation et n’affiche pas une capacité de décomposition pour faire son travail catalytique. Sur une période de 5 à 10 ans, grâce à de nombreuses opérations de lavage de fond du lit pour enlever les solides retenus, le support est dégradé par le contact entre les particules et l’abrasion mécanique. Ensuite, le matériel doit être remplacé.
OPÉRATION DE BASE :
Les processus qui ont lieu dans un lit de DMI-65 impliquent la réduction/oxydation (redox). Les réactions de Redox impliquent un transfert d’électrons entre les espèces. La réduction est le gain d’électrons ou une diminution de l’état d’oxydation d’une molécule, d’un atome ou d’un ion. L’oxydation est la perte d’électrons ou une augmentation de l’état d’oxydation d’une molécule, d’un atome ou d’un ion. Les réactions de Redox se produisent simultanément par lesquelles il ne peut y avoir une réaction de réduction sans une réaction d’oxydation. Les médias » aident » les réactions chimiques à se produire en interagissant avec la réaction sans être modifiés de façon permanente. Une discussion approfondie sur la chimie du redox est en dehors de la portée de ce document, il ne traitera que de la façon dont le processus de redox s’applique dans l’enlèvement du fer et du manganèse à l’aide de DMI-65. Les équations de redox individuelles seront couvertes dans les sections suivantes d’enlèvement de fer et de manganèse.
Afin de commencer le processus d’oxydation des ions en solution et de s’assurer que la couche oxydative n’est pas compromise, le support est conçu pour fonctionner en présence de chlore ou d’autres oxydants. Dans ce processus, l’oxydant enlève les électrons et est consommé dans le processus. L’exploitant doit s’assurer qu’il y a un résidu de chlore libre de 0,1 à 0,3 ppm dans l’eau des effluents.
Le chlore, alimenté sous forme d’hypochlorite de sodium (NaOCl) ou d’eau de Javel (12,5 NaOCl), est l’oxydant préféré puisqu’il est relativement peu coûteux, facilement disponible dans le monde entier et il est efficace. D’autres oxydants tels que le peroxyde d’hydrogène (H2O2), l’oxyde de chlore (CLO2) ou l’ozone peuvent également être utilisés tant qu’un résidu peut être mesuré et entretenu.
Une autre fonction du chlore est qu’il garde les médias exempts de croissance bactérienne ou visqueux. La surface catalytique de l’oxyde de manganèse doit rester propre afin que les ions dans l’eau puissent entrer en contact avec elle. Dans le même temps, le chlore est une source d’oxygène plus réactive que l’oxygène moléculaire. Le graphique suivant indique des niveaux sûrs pour d’autres constituants de l’eau qui pourraient interférer avec l’interaction de surface.
Contrairement aux résines d’échange d’ions où des doses régénérantes plus élevées augmenteront la capacité d’échange d’ions, les résidus de chlore ou les concentrations supérieures à ceux requis pour oxyder le Fe et le Mn n’augmentent pas les propriétés oxydatives des médias. En outre, puisque les médias sont souvent utilisés pour prétrerer les eaux avant un système d’osmose inverse (RO), un résidu de chlore libre plus élevé nécessiterait un traitement post-traitement plus étendu pour réduire le résidu résiduel pour protéger les membranes contre les attaques au chlore.
Le DMI-65 doit être activé avant d’être mis en service pour la première fois. Cette activation nécessite une dose plus élevée de chlore que celle utilisée pendant le fonctionnement normal, mais ne doit être effectuée qu’une seule fois pendant le démarrage initial. Le taux de dosage est de 10 onces de liquide de 12,5 chlore par pied cube (pi3)du support. L’activation ne nécessite qu’un trempage de plusieurs heures, mais un bain de nuit est préférable.
Une fois activé, le navire doit être lavé pour enlever l’excédent de NaOCl et les amendes. Étant donné que l’oxyde de manganèse est l’un des constituants utilisés dans la fabrication des médias, un rinçage prolongé est nécessaire au démarrage pour enlever toute trace d’oxyde de manganèse libre résiduel restant du processus de fabrication. Une fois que le niveau Mn dans l’eau de lavage atteint des valeurs de 0,05 à 0,15 ppm et le résidu de chlore libre est réglé le filtre est prêt à être mis en service.
Le remplacement des médias en raison de la diminution des propriétés de filtration physique des médias en raison de l’abrasion physique se produira avant la dégradation complète de la couche catalytique a lieu. Dans des conditions d’exploitation normales, la durée de vie des médias est estimée à 5 à 10 ans.
Précipitations et éliminations en fer (Fe) à l’aide de DMI 65
Le fer (Fe) est le quatrième élément le plus commun dans la croûte terrestre et existe dans un large éventail d’états d’oxydation de -2 à 6, bien que les états les plus courants soient ferreux (no 2) et ferric (no 3).
Les sels ferreux sont facilement solubles. Avant que le fer ferreux, un solide dissous communément trouvé comme bicarbonate ferreux, peut être enlevé par filtration, il doit être oxydé, devenir hydroxyde ferrique et dans les eaux neutres de pH précipiter dans le lit des médias. La surface catalytique de DMI-65 contient de l’oxyde de manganèse ou expose des sites de manganèse et d’oxygène pour l’adsorption des [Fe] ions qui sont dans l’eau. La réaction du bicarbonate ferreux et du NaOCl est presque instantanée et le bicarbonate ferreux s’oxyde (abandonne un OH–) pour devenir l’hydroxyde ferrique insoluble qui est ensuite enlevé par filtration dans la surface catalytique des médias. L’équation de réaction redox suivante explique le processus.
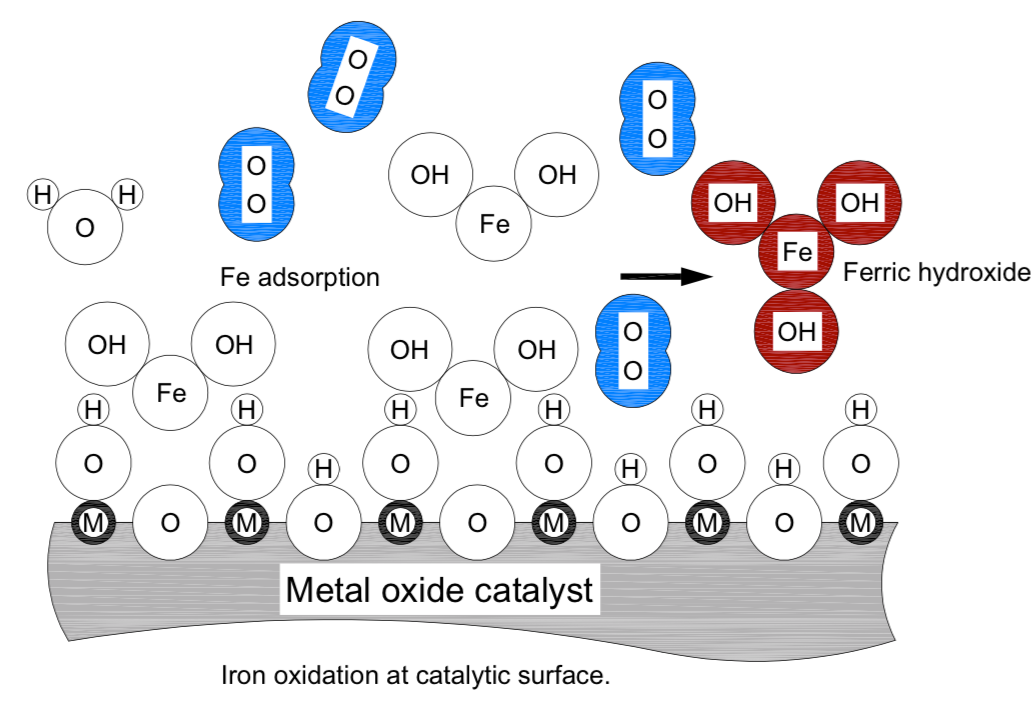
2Fe (HCO3)2 NaOCl – H2O ‘ 2Fe(OH)2 ‘2CO2 ‘ NaCl
Dans la figure ci-dessus, la surface catalytique est présentée sous une forme lisse simplifiée. Lettre «M» a été utilisé pour représenter un ion métallique générique dans le treillis de cette surface. La lettre «O», au centre des cercles, représente un atome d’oxygène. Diverses ions taille et molécule d’oxygène (bleu) sont représentés à l’échelle relative réelle. À l’exception de la molécule d’oxygène, les fers collés sont représentés comme des cercles tangentes. L’interprétation des lettres et des ions dans la figure « oxydation d’ion à la surface catalytique » est :
M : ion métallique générique dans le treillis de surface catalytique (MnMD); n 1, 2…
O : atome d’oxygène ou ion (O-)
Fe : atome de fer ou ion (Fe2, Fe3MD)
H : atome d’hydrogène ou ion (H)
OH: hydrooxyde, ou anion hydroxyl (OH-)
H2O, molécule d’eau montrée comme cercles tangentes
Fe (OH)2, l’hydroxyde ferreux est montré comme des cercles tangentes
Fe (OH)3, hydroxyde ferric, représenté comme des cercles tangentes, couleur brune
O2, molécule d’oxygène, atomes montrés à la distance de liaison covalente, couleur bleue
Le bicarbonate ferreux dissous est attiré par l’extrémité fe vers l’oxygène en treillis du matériau catalytique. Cela amène le Fe à proximité de liaison covalente avec l’ion d’hydroxyde d’un site voisin et le bicarbonate ferreux se transforme en hydroxyde ferrique insoluble qui précipite dans la forme cristalline des agrégats de taille de 3 nanomètres et plus grands. Les agrégats coagulent dans de plus grands troupeaux et sont conservés dans le lit catalytique.
Comme le bicarbonate ferreux est converti en hydroxyde ferric, sa concentration à la surface catalytique diminue. Dans la majeure partie de l’eau, loin de la surface catalytique, la concentration de bicarbonate ferreux est plus élevée, ce qui l’entraîne à se diffuser vers la concentration inférieure selon la loi de diffusion. Le flux de diffusion dépend linéairement du gradient de concentration sur la distance.
L’oxygène dissous contribue à la production d’ions d’hydroxyde par oxydation directe de l’hydrogène en combinaison avec Fe fractionnant la molécule d’eau et en réagissant avec l’hydrogène à la surface catalytique
Il est important de noter que bien qu’une source d’oxygène soit nécessaire oxydation et les précipitations de Fe sont entraînées par l’ion d’hydroxyde. Même dans des conditions relativement acides, les ions d’hydroxyde (une anion très forte) sont plus faciles à atteindre pour se liant à la Fe qu’à l’oxygène. Ainsi, Fe n’est pas très difficile à oxyder et à précipiter autour de l’état neutre de pH. En outre, la concentration d’ions hydroxyl augmente avec la valeur du pH de façon exponentielle, tout comme le taux d’oxydation et de précipitations de Fe.
Le chlore (généralement sous la forme de NaOCl) est une source d’oxygène plus réactive que l’oxygène moléculaire. Le résidu idéal à maintenir en aval du filtre catalytique est de 0,2 mg/l (0,1 à 0,3) de chlore libre. Un résidu plus élevé de chlore libre et donc plus élevé de taux d’hypochlorite de sodium dans le filtre catalytique n’aide pas toujours. Il pourrait avoir un effet négatif en raison de l’éventage du chlore et une augmentation des ions de sodium concurrents, Na. La surface catalytique doit être propre de sorte que les ions dans l’eau pourraient entrer en contact avec elle de sorte que le chlore injecté empêche également la croissance des bactéries et l’aglissement de la surface catalytique avec de la boue.
Manganèse, Mn précipitations et l’enlèvement à l’aide de DMI 65
DMI-65 est un matériau catalytique spécialement adapté à l’oxydation et à l’enlèvement du manganèse. La surface catalytique contient de l’oxyde de manganèse pour saumurer à proximité des atomes de manganèse et d’oxygène covalents de liaison de l’eau. Cependant, l’oxydation et l’enlèvement du manganèse (Mn) est très différent de celui de Fe. Une différence majeure est causée par la solubilité de l’oxyhydroxide de manganèse, MnO (OH)2.
Mn (HCO3)2 ‘ NaOCl ‘ MnO (OH)2 ‘ NaCl ‘ 2CO2
Le manganèse ne se précipite pas sous forme d’oxyhydroxide, mais comme oxyde, MnO2 et oxydes de valance plus élevés. La présence et la concentration des anions d’hydroxyde n’aident pas beaucoup dans les précipitations et l’élimination du manganèse. L’hydroxyde de manganèse sera attiré par l’extrémité du manganèse à l’oxygène dans la surface catalytique de treillis. Une molécule d’oxygène doit être disponible à proximité pour faciliter l’oxydation à travers l’oxygène du treillis et l’échange au treillis avec de l’oxygène moléculaire. Les conditions pour que cela se produise sont statistiquement moins probables et la réaction est d’un rythme beaucoup plus lent que l’oxydation de Fe par l’hydroxyde.
Bien que l’augmentation du pH aux niveaux alcalins facilite l’oxydation et l’élimination du manganèse, dans ces conditions, le manganèse oxydé pourrait également se dissoudre dans l’eau. Par conséquent, quel que soit le contaminant cible à enlever, les conditions anoxiques doivent toujours être évitées pour protéger la couche catalytique contre les lessivage dans l’eau. Lorsque l’oxydation du manganèse, le pH recommandé est proche de 8.
L’oxyde de manganèse a un bon effet autocatalytique. Lors du lavage de dos, il est préférable d’arrêter le processus avant que l’eau devient très claire. Les résidus d’oxyde de manganèse dans le lit filtrant amélioreront l’oxydation du manganèse.
Conditions d’exploitation DMI-65 clés
Les processus de traitement doivent être effectués de telle manière que la surface catalytique du matériau soit maintenue propre et accessible à l’ion de l’eau au contact.
L’eau avec une grande quantité de solides suspendus doit être clarifiée avant de la passer à travers le filtre catalytique avec DMI-65. Les niveaux acceptables de solides suspendus dépendent de leur nature. Une plus grande quantité de solides en suspension minérales que les solides en suspension organiques pourrait être manipulée.
Les bactéries pourraient se développer et déposer la boue sur DMI-65. Ainsi, les conditions de désinfectant et d’oxydation doivent être maintenues.
L’eau contenant des argiles et de grandes molécules organiques peut entraîner le dépôt de ce matériau à la surface du DMI 65 et l’abat-jour de la surface catalytique. Traitement pour l’élimination de ce contaminant avant que le filtre catalytique ne soit nécessaire.
Le polymère flocculent pourrait également coller à la surface catalytique DMI-65 et aveugle.
Des eaux souterraines dures et instables pourraient causer des dépôts à l’échelle dans le filtre catalytique et aveugler le matériau dans un bloc mono solide. Dans ce cas, le matériau DMI-65 dans le lit est perdu et devrait être remplacé. Il faut effectuer un traitement pour stabiliser l’eau pour empêcher la formation d’écailles dans le filtre catalytique.
Le pH acide bas et les conditions anoxiques pourraient causer la dissolution du manganèse de la couche catalytique de DMI-65 et la perte de sa capacité. Un pH excessivement élevé signifie une concentration excessive d’ions hydroxyl (corrosifs aux métaux) et pourrait également provoquer la dissolution du manganèse de la couche catalytique.
N’utilisez pas d’eau déminéralisée, d’eau distillée ou d’eau connue pour être fortement corrosive aux métaux pour le trempage initial et l’activation de DMI-65.











