Introdução
O objetivo deste artigo é fornecer aos usuários de mídia de filtragem de água catalítica DMI-65 informações qualitativas sobre como o material funciona, suas capacidades e limitações e permitir que eles apliquem o material aos processos de tratamento de água da maneira adequada e com confiança. O artigo evita a complexidade detalhada das camadas eletroquímicas de superfície sólida e da ciência coloidal, processos e reações físicas e químicas quantitativas. Para leitores que já possuem conhecimento significativo nessa área, o artigo traz mais compreensão do que é o DMI-65 e seu uso pretendido. Os recém-chegados a esta área são fornecidos com as bases, e talvez motivação, para direcionar seus estudos mais aprofundados como eles poderiam desejar.
História
Nos primeiros dias de tratamento da água, zeolitos de ocorrência natural (como os verdes de glauconita) foram usados para suavizar e remover o ferro e o manganês da maquiagem da caldeira e processar as águas. À medida que a demanda por água de maior qualidade aumentou (devido, em parte, a caldeiras de classe de pressão mais alta) a indústria de tratamento de água se afastou em grande parte desses produtos para suavizar as resinas de troca de íons sintéticos recém-desenvolvidas.
No entanto, no caso da remoção de ferro e manganês, esse movimento foi muito mais lento e o resultado foi que o uso de mídia de filtragem de glauconitas e (verdes e) continua até o momento presente. Greensand foi e é frequentemente usado como um passo de pré-tratamento antes dos processos de troca de íons, uma vez que o ferro em uma lata de água de ração pode e faz falta a resina de cáção. Outros processos incluem aeração e filtração de oxidação com filtros de mídia padrão ou tipos proprietários de mídia e/ou filtros
Embora tenha havido outros produtos e processos de remoção ferro/manganês desenvolvidos desde greensand foi introduzido o uso de verdes e continuou mesmo que houvesse várias questões que o tornaram uma mídia menos do que ideal. Exigia regeneração periódica com permanganato de potássio, não podia ser usado em águas de pH mais baixas < (6,2), tinha uma temperatura de operação relativamente baixa (80oF), e tendia a suavizar com o tempo, resultando em problemas de queda de pressão em taxas de fluxo mais altas. Além disso, o fornecimento poderia ocasionalmente ficar restrito devido a preocupações ambientais com as instalações de processamento ao longo da costa leste dos Estados Unidos.
Por causa dessas questões na década de 1970, empresas de tratamento de água e usuários finais começaram a manifestar interesse em “outra coisa” para substituir os verdes. Em resposta aos seus pedidos, cientistas e pesquisadores no Japão começaram a procurar maneiras de infundir agentes oxidantes em diferentes materiais matriciais. Sentiu-se que um produto produzido comercialmente poderia ser mais poderoso, ter melhores propriedades físicas e estar mais sujeito a melhorias e/ou modificações do que qualquer mídia natural.
Décadas de mais pesquisas e desenvolvimento da Tecnologia japonesa de Infusão resultaram no produto exclusivamente australiano, DMI-65, uma mídia catalítica granular usada para impulsionar os processos avançados de redução/oxidação (redox) na água. A mídia faz parte de uma ampla categoria de produtos que derivam sua ação física e química da interação de sua superfície de óxido de metal com as moléculas de água e íons em solução. Este produto é revolucionário devido à tecnologia proprietária de infusão que penetra o substrato de micro derramamentos do material da matriz, permitindo uma maior área de superfície catalítica e de uma distribuição apertada do tamanho das partículas. O DMI-65 tem baixo nível de multas, tolerância a uma faixa de pH mais ampla e superfície catalítica quimicamente infundida que não será consumida ou diminuída em condições normais de operação. Últimos 5 a 10 anos de uso contínuo.
Informações de fundo
O DMI-65 é uma mídia de filtragem de água catalítica extremamente poderosa que é projetada para a remoção de ferro e manganês em soluções aquosas (água) sem a necessidade de permanganato de potássio ou regeneração química. A estrutura microporosa única do DMI-65 remove eficientemente o ferro dissolvido para os níveis quase indetectáveis tão baixos quanto 0,001 ppm e manganês a 0,001 ppm. O DMI-65 atua como um catalisador de oxidação com oxidação imediata e filtragem dos precipitados insolúveis derivados desta reação de oxidação. O DMI-65 também pode remover arsênico, alumínio e outros metais pesados e sulfeto de hidrogênio sob certas condições.
O material faz parte da ampla categoria de produtos que derivam sua ação física e química da interação de sua superfície de óxido de metal com as moléculas de água e íons em solução.
A interação sólida da superfície com a água distingue entre a adsorção como as forças fracas van der Waal que mantêm uma molécula hidrofóbica em uma mídia central rígida, como carbono ativado e absorção como as fracas forças van der Waal que mantêm uma molécula hidrofóbica em uma matriz inchável (como benzeno) em um polímero de estireno T-butil ou absorção por extração líquido-líquido. As resinas de troca de íons utilizam processos de absorção enquanto a interação do DMI-65 com moléculas de água e íons em solução é iniciada através de adsorção.
Materiais adsorbent do tipo não catallítico retêm íons-alvo da água até que ambos os locais disponíveis para adsorção atinjam uma densidade máxima e saturação ou concentração de íons-alvo na água tratada atingem a máxima concentração aceitável. Neste ponto, o material adsorbent deve ser regenerado para remover ou substituir os íons contaminantes, ou o material usado é substituído por um novo material que é carregado no recipiente de tratamento. Quando o processo funciona trocando um tipo de íon por íons-alvo da água, o processo é chamado de troca de íons. Esta categoria de adsorbent e alguns materiais parcialmente absorventes removem os íons-alvo da água. Quanto maior a superfície por volume de material, maior a quantidade de íons-alvo contaminantes que poderiam ser retidos da água.
Materiais puramente catalíticos adsorb os íons reagentes da solução trazendo-os na proximidade da ligação química. Em seguida, o produto de reação se afasta da superfície do catalisador. Catalisadores estritamente falando facilitam reações químicas; eles não removem implicitamente nada. Se o produto de reação for um precipitado sólido, muitas vezes o produto é retido no leito catalítico, portanto removido pela filtração.
Muitos materiais atuam em um modo misto; com a troca de íons e a ação catalítica acontecendo. Para aqueles materiais utilizados principalmente para sua ação catalítica, a troca de íons resultando na dissolução da camada catalítica leva à necessidade de regeneração periódica ou reativação para corrigir a matriz de íons em sua superfície ativa.
DMI-65 – Mídia Catalítica de Oxidação Avançada
DMI-65 é um material granular de cor marrom escuro para preto. Esta cor é produzida pelo óxido de manganês nas camadas externas dos grânulos. O DMI-65 é uma mídia catalítica no verdadeiro significado da palavra e facilita a oxidação – precipitação – filtração e não é consumida nas reações. Estritamente falando, a mídia facilita reações químicas e não remove explicitamente nada. Uma vez oxidado, o aspecto de filtragem de profundidade da mídia remove os sólidos que são periodicamente lavados para fora dos vasos do filtro.
A mídia não precisa de regeneração ou reativação e não exibe uma capacidade em decomposição para fazer seu trabalho catalítico. Ao longo de 5 a 10 anos, através de muitas operações de backwashing do leito para remover sólidos retidos, a mídia é degradada pelo contato entre partículas e abrasão mecânica. Então o material tem que ser substituído.
OPERAÇÃO BÁSICA:
Os processos que ocorrem em um leito de DMI-65 envolvem redução/oxidação (redox). As reações de Redox envolvem uma transferência de elétrons entre espécies. Redução é o ganho de elétrons ou uma diminuição no estado de oxidação de uma molécula, átomo ou íon. Oxidação é a perda de elétrons ou um aumento no estado de oxidação de uma molécula, átomo ou íon. As reações de redox ocorrem simultaneamente em que não pode haver uma reação de redução sem uma reação de oxidação. A mídia “ajuda” as reações químicas a ocorrer interagindo com a reação sem serem permanentemente alteradas. Uma discussão aprofundada sobre a química redox está fora do escopo deste artigo, só vai lidar com a forma como o processo redox se aplica na remoção de ferro e manganês usando DMI-65. As equações individuais de redox serão cobertas nas seguintes seções de remoção de ferro e manganês.
A fim de iniciar o processo de oxidação dos íons em solução e para garantir que a camada oxidativa não seja comprometida, a mídia é projetada para operar na presença de cloro ou outro oxidante. Nesse processo, o oxidante remove elétrons e é consumido no processo. O operador precisa garantir que haja um resíduo de cloro livre de 0,1 – 0,3 ppm na água do efluente.
O cloro, alimentado como hipoclorito de sódio (NaOCl) ou alvejante (12,5 NaOCl), é o oxidante preferido, pois é relativamente barato, prontamente disponível em todo o mundo e é eficaz. Outros oxidantes como peróxido de hidrogênio (H2O2), óxidode cloro (CI2) ou ozônio também podem ser usados desde que um residual possa ser medido e mantido.
Outra função do cloro é que mantém a mídia livre do crescimento bacteriano ou de lodo. A superfície catalítica de óxido de manganês deve permanecer limpa para que os íons na água possam entrar em contato com ele. Ao mesmo tempo, o cloro é uma fonte de oxigênio mais reativo do que o oxigênio molecular. O gráfico a seguir indica níveis seguros para outros constituintes de água que poderiam interferir na interação superficial.
Ao contrário das resinas de troca de íons, onde doses regenerantes mais altas aumentarão a capacidade de troca de íons, resíduos de cloro ou concentrações superiores às necessárias para oxidar o Fe e Mn não aumentam as propriedades oxidativas da mídia. Além disso, uma vez que a mídia é frequentemente usada para pré-tratamento de águas antes de um sistema de Osmose Reversa (RO) um residual de cloro livre mais alto exigiria um tratamento pós-tratamento mais extenso para reduzir o residual para proteger as membranas do ataque de cloro.
O DMI-65 deve ser ativado antes de ser colocado em serviço pela primeira vez. Esta ativação requer uma dosagem maior de cloro do que o usado durante a operação normal, mas só deve ser realizada uma vez durante a inicial inicial. A taxa de dosagem é de 10 onças fluidas de 12,5 cloro por pé cúbico (ft3) da mídia. A ativação requer apenas um mergulho de várias horas, mas um mergulho noturno é preferido.
Uma vez ativado, o navio deve ser lavado novamente para remover o excesso de NaOCl e quaisquer multas. Uma vez que o óxido de manganês é um dos constituintes usados na fabricação da mídia é necessário enxaguar estendido no início para remover qualquer traço livre de óxido de manganês residual que sobrou do processo de fabricação. Uma vez que o nível Mn na água de lavagem traseira atinja valores de 0,05 a 0,15 ppm e o residual de cloro livre é definido o filtro está pronto para ser colocado em serviço.
A substituição da mídia devido à diminuição das propriedades de filtragem física da Mídia devido à abrasão física ocorrerá antes da degradação completa da camada catalítica ocorrer. Em condições normais de operação, a vida útil da mídia é estimada em 5 a 10 anos.
Precipitação e remoção de ferro (Fe) usando DMI 65
O ferro (Fe) é o quarto elemento mais comum encontrado na crosta terrestre e existe em uma ampla gama de estados de oxidação de -2 a +6, embora os estados mais comuns sejam ferrosos (+2) e férricos (+3).
Sais ferrosos são prontamente solúveis. Antes do ferroso, um sólido dissolvido comumente encontrado como bicarbonato ferroso, pode ser removido por filtração deve ser oxidado, tornar-se hidróxido férrico e em águas neutras de pH precipitar-se no leito de mídia. A superfície catalítica do DMI-65 contém óxido de manganês ou expõe manganês e locais de oxigênio para adsorção de [Fe] íons que estão na água. A reação do bicarbonato ferroso e da NaOCl é quase instantânea e o ferroso bicarbonato oxida (desiste de um OH–) para se tornar o hidróxido ferrítico insolúvel que é então removido através da filtração na superfície catalítica da mídia. A seguinte equação de reação redox explica o processo.
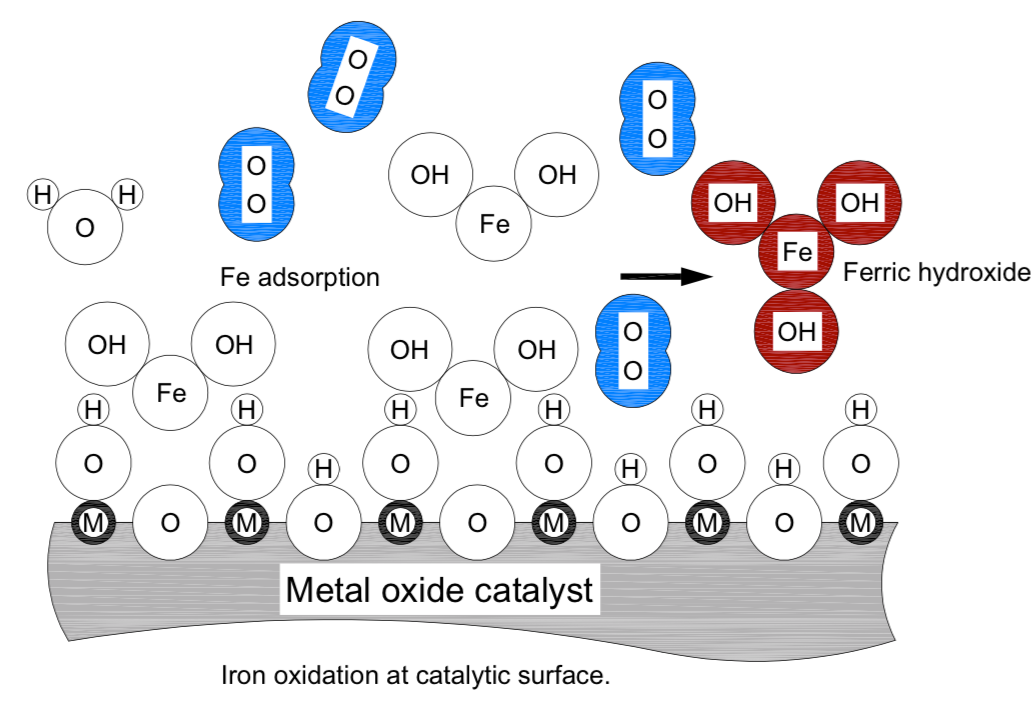
2Fe(HCO3)2 + NaOCl + H2O + 2Fe(OH)2 + 2CO2 + NaCl
Na figura acima, a superfície catalítica é apresentada de forma suave simplificada. A letra “M” foi usada para representar um íon metálico genérico na rede desta superfície. A letra “O”, no centro dos círculos, representa um átomo de oxigênio. Vários tamanhos de íons e molécula de oxigênio (azul) são representados em verdadeira escala relativa. Exceto a molécula de oxigênio, ferros ligados são mostrados como círculos tangentes. A interpretação para letras e íons na figura “Ion oxidação na superfície catalítica” é:
M: íon metálico genérico na rede de superfície catalítica (Mn+); n = 1, 2…
O: átomo de oxigênio ou íon (O-)
Fe: átomo de ferro ou íon (Fe2+, Fe3+)
H: átomo de hidrogênio ou íon (H+)
OH: hidróxido, ou ânion hidroxyl (OH-)
H2O, molécula de água mostrada como círculos tangentes
Fe (OH)2, hidróxido ferroso é mostrado como círculos tangentes
Fe (OH)3, hidróxido férrico, mostrado como círculos tangentes, cor marrom
O2, molécula de oxigênio, átomos mostrados a distância de ligação covalente, cor azul
O bicarbonato ferroso dissolvido é atraído com o fim fe em direção ao oxigênio da rede do material catalítico. Isso traz o Fe na proximidade da ligação covalente com o íon hidróxido de um sítio vizinho e o bicarbonato ferroso se transforma em hidróxido ferrítico insolúvel que precipita em forma cristalina agregados de tamanho a partir de 3 nanômetros e maiores. Os agregados coagulam em rebanhos maiores e são retidos no leito catalítico.
À medida que o bicarbonato ferroso é convertido em hidróxido férrico, sua concentração na superfície catalítica diminui. Na maior parte da água, longe da superfície catalítica, a concentração de bicarbonato ferroso é maior, resultando em difusão para a menor concentração de acordo com a lei de difusão. O fluxo de difusão é linearmente dependente com gradiente de concentração à distância.
O oxigênio dissolvido contribui para a produção de íons hidróxidos através da oxidação direta do hidrogênio em combinação com Fe dividindo a molécula da água e reagindo com o hidrogênio na superfície catalítica
É importante notar que, embora uma fonte de oxigênio seja necessária oxidação e precipitação de Fe é impulsionada pelo íon hidróxido. Mesmo sob condições relativamente ácidas íons hidróxidos (um ânion muito forte) são mais fáceis de se ligar a Fe do que oxigênio. Assim, Fe não é muito difícil de oxidar e precipitar em torno da condição de pH neutro. Além disso, a concentração de íons hidroxil aumenta exponencialmente com o valor do pH, assim como a taxa de oxidação e precipitação de Fe.
Cloro (geralmente na forma de NaOCl) é uma fonte de oxigênio mais reativa do que o oxigênio molecular. O resíduo ideal a ser mantido a jusante do filtro catalítico é 0,2 mg/l (0,1 a 0,3) cloro livre. Um resíduo mais alto de cloro livre e, portanto, maior nível de hipoclorito de sódio no filtro catalítico nem sempre ajuda. Pode ter um efeito adverso devido à ventilação de cloro e um aumento de íons de sódio concorrentes, Na+. A superfície catalítica tem que estar limpa para que íons na água possam entrar em contato com ela para que o cloro injetado também impeça o crescimento de bactérias e a cegueira da superfície catalítica com lodo.
Manganês, precipitação e remoção de Mn usando DMI 65
DMI-65 é um material catalítico especificamente adaptado à oxidação e remoção de manganês. A superfície catalítica contém óxido de manganês para brining na proximidade de manganês de ligação covalente e átomos de oxigênio da água. No entanto, a oxidação e remoção de manganês (Mn) é muito diferente da de Fe. Uma grande diferença é causada pela solubilidade do manganês oxyhydroxide, MnO(OH)2.
Mn(HCO3)2 + NaOCl + MnO(OH)2 + NaCl + 2CO2
O manganês não precipita como oxhidroxida, mas como óxido,óxidos MnO 2 e óxidos de valência mais elevados. A presença e concentração de ânions de hidróxido não ajuda muito na precipitação e remoção do manganês. O hidróxido de manganês será atraído com a extremidade do manganês para o oxigênio na superfície da rede catalítica. Uma molécula de oxigênio deve estar disponível nas proximidades para facilitar a oxidação através do oxigênio da rede e trocar para a rede com oxigênio molecular. As condições para que isso aconteça são estatisticamente menos prováveis e a reação é de taxa muito mais lenta do que a oxidação de Fe via hidróxido.
Enquanto o aumento do pH para níveis alcalinos facilita a oxidação e a remoção do manganês, nessas condições o manganês oxidado também pode dissolver-se de volta na água. Consequentemente, independentemente do contaminante alvo a ser removido, as condições anoxicas devem ser sempre evitadas para proteger a camada catalítica contra a lixiviação na água. Ao oxidar manganês o pH recomendado é próximo de 8.
Óxido de manganês tem bom efeito autocatalítico. Ao lavar de costas é melhor parar o processo antes que a água fique muito clara. O resíduo de óxido de manganês na cama do filtro aumentará a oxidação do manganês.
Principais condições operacionais DMI-65
Os processos de tratamento devem ser conduzidos dessa forma para que a superfície catalítica do material seja mantida limpa e disponível para íons da água ao contato.
A água com uma grande quantidade de sólidos suspensos deve ser esclarecida antes de passá-la através do filtro catalítico com DMI-65. Os níveis aceitáveis de sólidos suspensos dependem de sua natureza. Uma quantidade maior de sólidos minerais suspensos do que os sólidos orgânicos suspensos poderia ser manuseada.
Bactérias podem crescer e depositar lodo no DMI-65. Assim, as condições de desinfetante e oxidação devem ser mantidas.
A água contendo argilas e grandes moléculas orgânicas pode resultar na deposição desse material na superfície do DMI 65 e cegueira da superfície catalítica. Tratamento para remoção desse contaminante antes que o filtro catalítico seja necessário.
Floculante de polímero também pode grudar no DMI-65 e na superfície catalítica cega.
Águas subterrâneas duras e instáveis podem causar deposição em escala no filtro catalítico e cegar o material em um bloco mono sólido. Nesse caso, o material DMI-65 na cama é perdido e teria que ser substituído. É preciso realizar o tratamento para estabilização da água para evitar a formação de escala no filtro catalítico.
Tanto o pH ácido baixo quanto as condições anoxicas podem causar dissolução de manganês da camada catalítica do DMI-65 e perda de sua capacidade. PH excessivamente alto significa concentração excessiva de íons hidroxil (corrosivos para metais) e também pode causar dissolução de manganês da camada catalítica.
Não utilize água desmineralizada, água destilada ou água conhecida por ser fortemente corrosiva para metais para imersão inicial e ativação do DMI-65.











