Introducción
El propósito de este documento es proporcionar a los usuarios de los medios de filtración de agua catalítica DMI-65 información cualitativa sobre cómo funciona el material, sus capacidades y limitaciones y permitirles aplicar el material a los procesos de tratamiento de agua de la manera adecuada y con confianza. El documento evita la complejidad detallada de las capas electroquímicas de superficie sólida y la ciencia coloidal, procesos y reacciones físicas y químicas cuantitativas. Para los lectores que ya tienen un conocimiento significativo en esta área, el documento aporta una mayor comprensión de lo que es DMI-65 y su uso previsto. A los recién llegados a esta área se les proporcionan las bases, y tal vez la motivación, para dirigir sus estudios más profundos como deseen.
Historia
En los primeros días del tratamiento del agua, las zeolitas de origen natural (como la verde glauconita) se utilizaban para suavizar y eliminar el hierro y el manganeso del maquillaje de la caldera y procesar las aguas. A medida que aumentaba la demanda de agua de mayor calidad (debido en parte a calderas de mayor presión), la industria de tratamiento de agua se alejó en gran medida de estos productos para suavizar a las resinas de intercambio iónico sintético recién desarrolladas.
Sin embargo, en el caso de la eliminación de hierro y manganeso este movimiento fue mucho más lento y el resultado fue que el uso de medios de filtración de glauconita greensand (greensand) continúa hasta el momento actual. Greensand fue y se utiliza a menudo como un paso de pretratamiento antes de los procesos de intercambio iónico ya que el hierro en una lata de agua de alimentación y ensucia la resina catiónica. Otros procesos incluyen aireación y filtración de oxidación con filtros de medios estándar o tipos patentados de medios y/o filtros
Si bien ha habido otros productos y procesos de eliminación de hierro/manganeso desarrollados desde greensand se introdujo el uso de greensand continuó a pesar de que había varios problemas que lo hicieron un medio menos que ideal. Requería regeneración periódica con permanganato de potasio, no podía ser utilizado en aguas de pH más bajas ( < 6.2), tenía una temperatura de funcionamiento relativamente baja (80oF), y tendía a ablandarse a través del tiempo resultando en problemas de caída de presión a velocidades de flujo más altas. Además, el suministro ocasionalmente podría quedar restringido debido a preocupaciones ambientales con las instalaciones de procesamiento a lo largo de la costa oriental de los Estados Unidos.
Debido a estos problemas en la década de 1970, las empresas de tratamiento de agua y los usuarios finales comenzaron a expresar su interés en «algo más» para reemplazar a los greensand. En respuesta a sus peticiones, científicos e investigadores en Japón comenzaron a buscar maneras de infundir agentes oxidantes a diferentes materiales de matriz. Se consideró que un producto producido comercialmente podía hacerse más potente, tener mejores propiedades físicas y estar más sujeto a mejoras y/o modificaciones que cualquier medio natural.
Décadas de investigación y desarrollo de la tecnología de infusión japonesa han dado como resultado el producto de fabricación única australiana, DMI-65 un medio catalítico granular utilizado para impulsar los procesos avanzados de reducción/ oxidación (redox) en el agua. Los medios forman parte de una amplia categoría de productos que derivan su acción física y química de la interacción de su superficie de óxido metálico con las moléculas de agua y los iones en solución. Este producto es revolucionario gracias a la tecnología de infusión patentada que penetra en el sustrato micro vertido del material de la matriz, lo que permite una mayor superficie catalítica y una distribución apretada del tamaño de las partículas. DMI-65 tiene bajo nivel de multas, una tolerancia a un rango de pH más amplio y una superficie catalítica infundida químicamente que no se consumirá ni disminuirá en condiciones normales de funcionamiento. Los últimos 5 – 10 años de uso continuo.
Información de antecedentes
DMI-65 es un medio de filtración de agua catalítico extremadamente potente que está diseñado para la eliminación de hierro y manganeso en soluciones acuosas (agua) sin necesidad de permanganato de potasio o regeneración química. La estructura microporosa única de DMI-65 elimina eficientemente el hierro disuelto a los niveles casi indetectables de tan solo 0,001 ppm y manganeso a 0,001 ppm. DMI-65 actúa como catalizador de oxidación con oxidación inmediata y filtración de los precipitados insolubles derivados de esta reacción de oxidación. DMI-65 también puede eliminar arsénico, aluminio y otros metales pesados y sulfuro de hidrógeno bajo ciertas condiciones.
El material forma parte de la amplia categoría de productos que derivan su acción física y química de la interacción de su superficie de óxido metálico con las moléculas de agua y los iones en solución.
La interacción sólida de la superficie con el agua distingue entre la adsorción como las fuerzas débiles de van der Waal que sostienen una molécula hidrófoba en un medio central rígido como el carbón activado y la absorción, ya que las fuerzas débiles de van der Waal que sostienen una molécula hidrófoba en una matriz hinchable (como el benceno) en un polímero de estireno-butilo o la absorción por extracción de líquido-líquido. Las resinas de intercambio de iones utilizan procesos de absorción, mientras que la interacción de DMI-65 con moléculas de agua e iones en solución se inicia a través de la adsorción.
Los materiales adsorbentes de tipo no catalítico retienen los iones objetivo del agua hasta que cualquiera de los sitios disponibles para la adsorción alcance una densidad máxima y la saturación o concentración de iones diana en el agua tratada alcance la concentración máxima aceptable. En este punto, el material adsorbente debe regenerarse para eliminar o reemplazar los iones contaminantes, o el material utilizado se sustituye por material nuevo que se carga en el contenedor de tratamiento. Cuando el proceso funciona intercambiando un tipo de iones por iones de destino del agua, el proceso se denomina intercambio iónico. Esta categoría de adsorbente y algunos materiales parcialmente absorbentes eliminan los iones diana del agua. Cuanto mayor sea la superficie por volumen de material, mayor será la cantidad de iones objetivo contaminantes que podrían ser retenidos del agua.
Los materiales puramente catalíticos absorben los iones reactivos de la solución llevándolos a la proximidad de la unión química. A continuación, el producto de reacción se aleja de la superficie del catalizador. Los catalizadores estrictamente hablando facilitan las reacciones químicas; no eliminan implícitamente nada. Si el producto de reacción es un precipitado sólido, a menudo el producto se retiene en el lecho catalítico, por lo tanto se elimina por filtración.
Muchos materiales actúan en un modo mixto; con intercambio iónico y acción catalítica. Para aquellos materiales utilizados principalmente para su acción catalítica, el intercambio iónico que resulta en la disolución de la capa catalítica conduce a la necesidad de regeneración o reactivación periódica para corregir la matriz de iones en su superficie activa.
DMI-65 – Medios catalíticos de oxidación avanzada
DMI-65 es un material granular de color marrón oscuro a negro. Este color es producido por el óxido de manganeso en las capas externas de los gránulos. DMI-65 es un medio catalítico en el verdadero significado de la palabra y facilita la oxidación – precipitación – filtración y no se consume en las reacciones. Estrictamente hablando, los medios de comunicación facilitan las reacciones químicas y no eliminan explícitamente nada. Una vez oxidado, el aspecto de filtración de profundidad de los medios elimina los sólidos que luego se sacan periódicamente de los recipientes del filtro.
El medio no necesita regeneración o reactivación y no muestra una capacidad en descomposición para realizar su trabajo catalítico. Durante un período de 5 a 10 años, a través de muchas operaciones de retrolavado de la cama para eliminar los sólidos retenidos, el medio se degrada por el contacto entre las partículas y la abrasión mecánica. Entonces el material tiene que ser reemplazado.
FUNCIONAMIENTO BASICO:
Los procesos que tienen lugar en un lecho de DMI-65 implican reducción/oxidación (redox). Las reacciones redox implican una transferencia de electrones entre especies. La reducción es la ganancia de electrones o una disminución en el estado de oxidación de una molécula, átomo o iones. La oxidación es la pérdida de electrones o un aumento en el estado de oxidación de una molécula, átomo o iones. Las reacciones redox ocurren simultáneamente por lo que no puede haber una reacción de reducción sin una reacción de oxidación. Los medios «ayudan» a que se produzcan reacciones químicas al interactuar con la reacción sin ser alterados permanentemente. Una discusión en profundidad sobre la química redox está fuera del alcance de este documento, sólo tratará sobre cómo se aplica el proceso redox en la eliminación de hierro y manganeso utilizando DMI-65. Las ecuaciones redox individuales se cubrirán en las siguientes secciones de eliminación de hierro y manganeso.
Con el fin de iniciar el proceso de oxidación de los iones en solución y para asegurar que la capa oxidativa no se ve comprometida el medio está diseñado para operar en presencia de cloro u otro oxidante. En este proceso el oxidante elimina electrones y se consume en el proceso. El operador debe asegurarse de que hay un residuo de cloro libre de 0,1 a 0,3 ppm en el agua del efluente.
El cloro, alimentado como hipoclorito de sodio (NaOCl) o lejía (12,5 NaOCl), es el oxidante preferido ya que es relativamente barato, fácilmente disponible en todo el mundo y es eficaz. Otros oxidantes como el peróxido de hidrógeno (H2O2),el óxido de cloro (ClO2)o el ozono también se pueden utilizar siempre y cuando se pueda medir y mantener un residuo.
Otra función del cloro es que mantiene los medios libres de crecimiento bacteriano o limo. La superficie catalítica de óxido de manganeso debe permanecer limpia para que los iones en el agua puedan entrar en contacto con ella. Al mismo tiempo, el cloro es una fuente de oxígeno más reactiva que el oxígeno molecular. La siguiente tabla indica niveles seguros para otros componentes del agua que podrían interferir con la interacción de la superficie.
A diferencia de las resinas de intercambio iónico donde dosis regeneradoras más altas aumentarán la capacidad de intercambio iónico, los residuos de cloro o concentraciones superiores a las necesarias para oxidar el Fe y el Mn no aumentan las propiedades oxidativas de los medios. Además, dado que los medios se utilizan a menudo para pretratar las aguas antes de un sistema de ósmosis inversa (RO), un residuo de cloro libre más alto requeriría un tratamiento posterior más extenso para reducir el residuo para proteger las membranas del ataque de cloro.
El DMI-65 debe activarse antes de ponerse en servicio por primera vez. Esta activación requiere una dosis más alta de cloro que la utilizada durante el funcionamiento normal, pero sólo tiene que realizarse una vez durante el arranque inicial. La tasa de dosificación es de 10 onzas líquidas de 12,5 cloro por pie cúbico (ft3) del medio. La activación sólo requiere un remojo de varias horas, pero se prefiere un remojo durante la noche.
Una vez activado, los recipientes deben ser lavados hacia atrás para eliminar el exceso de NaOCl y cualquier multa. Dado que el óxido de manganeso es uno de los componentes utilizados en la fabricación de los medios, se requiere un enjuague extendido al inicio para eliminar cualquier rastro de óxido de manganeso residual sobrante del proceso de fabricación. Una vez que el nivel Mn en el agua de retrolavado alcanza valores de 0.05 a 0.15 ppm y el residuo de cloro libre se establece el filtro está listo para ser puesto en servicio.
El reemplazo de medios debido a la disminución de las propiedades de filtración física de los medios debido a la abrasión física ocurrirá antes de que se produzca la degradación completa de la capa catalítica. En condiciones normales de funcionamiento, la vida útil de los medios se estima en 5 – 10 años.
Hierro (Fe) precipitación y eliminación con DMI 65
El hierro (Fe) es el cuarto elemento más común que se encuentra en la corteza terrestre y existe en una amplia gama de estados de oxidación de -2 a +6, aunque los estados más comunes son ferrosos (+2) y férricos (+3).
Las sales ferrosas son fácilmente solubles. Antes de que el hierro ferroso, un sólido disuelto comúnmente encontrado como bicarbonato ferroso, se puede eliminar por filtración debe oxidarse, convertirse en hidróxido férrico y en aguas de pH neutro precipitarse en el lecho de medios. La superficie catalítica de DMI-65 contiene óxido de manganeso o expone sitios de manganeso y oxígeno para la adsorción de [Fe] iones que están en el agua. La reacción del bicarbonato ferroso y el NaOCl es casi instantánea y el bicarbonato ferroso se oxida (renuncia a un OH–) para convertirse en el hidróxido férrico insoluble que luego se elimina a través de la filtración en la superficie catalítica de los medios. La siguiente ecuación de reacción redox explica el proceso.
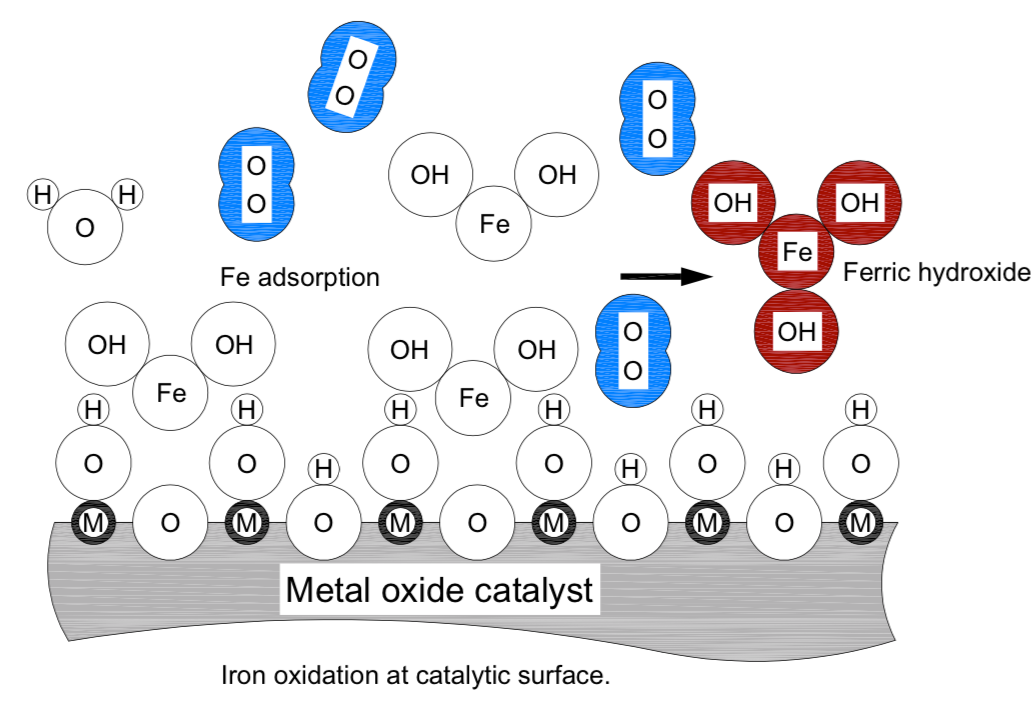
2Fe(HCO3)2 + NaOCl + H2O + 2Fe(OH)2 + 2CO2 + NaCl
En la figura anterior, la superficie catalítica se presenta en una forma suave simplificada. La letra «M» se utilizó para representar un ion metálico genérico en la celosía de esta superficie. La letra «O», en el centro de los círculos, representa un átomo de oxígeno. Varios tamaños iónicos y moléculas de oxígeno (azul) se representan a escala relativa verdadera. Excepto la molécula de oxígeno, los hierros unidos se muestran como círculos tangentes. La interpretación de letras e iones en la figura «Oxidación de iones en superficie catalítica» es:
M: ion metálico genérico en la celosía de superficie catalítica (Mn+); n 1, 2…
O: átomo de oxígeno o ion (O-)
Fe: átomo de hierro o ion (Fe2+, Fe3+)
H: átomo de hidrógeno o ion (H+)
OH: hidróxido, o hidroxilo anión (OH-)
H2O, molécula de agua que se muestra como círculos tangentes
Fe (OH)2, el hidróxido ferroso se muestra como círculos tangentes
Fe (OH)3, hidróxido férrico, mostrado como círculos tangentes, de color marrón
O2, molécula de oxígeno, átomos mostrados a distancia de unión covalente, color azul
El bicarbonato ferroso disuelto se atrae con el extremo Fe hacia el oxígeno de la celosía del material catalítico. Esto lleva al Fe en la proximidad de la unión covalente con el ion hidróxido de un sitio vecino y el bicarbonato ferroso cambia en hidróxido férrico insoluble que se precipita en forma cristalina agregados de tamaño de 3 nanómetros y más grandes. Los agregados se coagulan en bandadas más grandes y se conservan en el lecho catalítico.
A medida que el bicarbonato ferroso se convierte en hidróxido férrico, su concentración en la superficie catalítica disminuye. En la mayor parte del agua, lejos de la superficie catalítica, la concentración de bicarbonato ferroso es mayor, lo que resulta en que se difunda hacia la menor concentración de acuerdo con la ley de difusión. El flujo de difusión depende linealmente con gradiente de concentración a lo largo de la distancia.
El oxígeno disuelto contribuye a la producción de iones de hidróxido a través de la oxidación directa del hidrógeno en combinación con Fe dividiendo la molécula de agua y reaccionando con el hidrógeno en la superficie catalítica
Es importante tener en cuenta que aunque se necesita una fuente de oxígeno oxidación y la precipitación de Fe es impulsada por el ion hidróxido. Incluso en condiciones relativamente ácidas los iones de hidróxido (un anión muy fuerte) son más fáciles de unir a Fe que al oxígeno. Por lo tanto, Fe no es muy difícil de oxidar y precipitar alrededor de la condición de pH neutro. Además, la concentración de iones hidroxilo aumenta con el valor de pH exponencialmente y también lo hace la tasa de oxidación y precipitación de Fe.
El cloro (generalmente en forma de NaOCl) es una fuente de oxígeno más reactivo que el oxígeno molecular. El residuo ideal que se debe mantener aguas abajo del filtro catalítico es el cloro libre de 0,2 mg/l (0,1 a 0,3). Un mayor residuo de cloro libre y, por lo tanto, un mayor nivel de hipoclorito de sodio en el filtro catalítico no siempre ayuda. Podría tener un efecto adverso debido a la ventilación de cloro y un aumento de los iones de sodio de la competencia, Na+. La superficie catalítica tiene que estar limpia para que los iones en el agua puedan entrar en contacto con ella para que el cloro inyectado también impida el crecimiento de bacterias y cegar la superficie catalítica con baba.
Precipitación de manganeso, Mn y eliminación con DMI 65
DMI-65 es un material catalítico específicamente adaptado a la oxidación y eliminación del manganeso. La superficie catalítica contiene óxido de manganeso para entrar en la proximidad del manganeso de unión covalente y átomos de oxígeno del agua. Sin embargo, la oxidación y eliminación del manganeso (Mn) es muy diferente de la de Fe. Una diferencia importante es causada por la solubilidad del oxicorte de manganeso, MnO(OH)2.
Mn(HCO3)2 + NaOCl + MnO(OH)2 + NaCl + 2CO2
El manganeso no se precipita como oxhidróxido, sino como óxido, MnO2 y óxidos de valencia más altos. La presencia y concentración de aniones de hidróxido no ayuda mucho en la precipitación y eliminación de manganeso. El hidróxido de manganeso se atraerá con el extremo del manganeso al oxígeno en la superficie de celosía catalítica. Una molécula de oxígeno tiene que estar disponible en la proximidad para facilitar la oxidación a través del oxígeno de la celosía y el intercambio a la celosía con oxígeno molecular. Las condiciones para que esto suceda son estadísticamente menos probables y la reacción es de una velocidad mucho más lenta que la oxidación de Fe a través del hidróxido.
Mientras que los aumentos en el pH a los niveles alcalinos facilitan la oxidación y eliminación del manganeso, en estas condiciones el manganeso oxidado también podría disolverse de nuevo en el agua. Por lo tanto, independientemente del contaminante objetivo que se va a eliminar, las condiciones anóxicas siempre deben evitarse para proteger la capa catalítica contra la lixiviación en el agua. Al oxidar el manganeso, el pH recomendado es cercano a 8.
El óxido de manganeso tiene un buen efecto autocatalítico. Cuando se retrolava, es mejor detener el proceso antes de que el agua se vuelva muy clara. El residuo de óxido de manganeso en el lecho filtrante mejorará la oxidación del manganeso.
Condiciones clave de funcionamiento del DMI-65
Los procesos de tratamiento deben llevarse a cabo de tal manera que la superficie catalítica del material se mantenga limpia y disponible para ion desde el agua hasta el contacto.
El agua con una gran cantidad de sólidos suspendidos debe aclararse antes de pasarla a través del filtro catalítico con DMI-65. Los niveles aceptables de sólidos suspendidos dependen de su naturaleza. Se podría manipular una mayor cantidad de sólidos minerales suspendidos que los sólidos orgánicos suspendidos.
Las bacterias podrían crecer y depositar limo en DMI-65. Por lo tanto, deben mantenerse las condiciones de desinfectante y oxidación.
El agua que contiene arcillas y moléculas orgánicas grandes puede resultar en la deposición de dicho material en la superficie de DMI 65 y cegador de la superficie catalítica. Tratamiento para la eliminación de dicho contaminante antes de que se necesite el filtro catalítico.
El floculante de polímero también podría adherirse al DMI-65 y a la superficie catalítica ciega.
Las aguas subterráneas duras e inestables podrían causar una deposición a escala en el filtro catalítico y cegar el material en un monobloque sólido. En tal caso, el material DMI-65 en la cama se pierde y tendría que ser reemplazado. Se debe realizar un tratamiento para estabilizar el agua para evitar la formación de escamas en el filtro catalítico.
Tanto el pH ácido bajo como las condiciones anóxicas podrían causar la disolución del manganeso de la capa catalítica de DMI-65 y la pérdida de su capacidad. El pH excesivamente alto significa una concentración excesiva de iones hidroxilo (corrosivos para los metales) y también podría causar la disolución del manganeso de la capa catalítica.
No utilice agua desmineralizada, agua destilada o agua que se sepa que es fuertemente corrosiva para los metales para el remojo inicial y la activación de DMI-65.











